Fånga proteindynamik i trånga miljöer med Europeiska XFEL
Proteiner är ansvariga för många av kroppens funktioner och genom att förstå proteindynamiken i celler kan forskare lära sig mer om läkemedelsdesign och sjukdomspatologi. Nu har en internationell forskargrupp identifierat ett nytt sätt att undersöka proteindynamiken med hjälp av den höga repetitionsfrekvensen och koherensen hos de röntgenblixtar som produceras av den europeiska röntgenfrielektronlasern (EuXFEL). I studien, som publiceras i Nature Communications, används en teknik som kallas megahertz X-ray photon correlation spectroscopy (MHz-XPCS) och kan öppna nya tillämpningar inom hälsa och läkemedel.
Studien leddes av Stockholms universitet, universitetet i Tübingen, universitetet i Siegen och EuXFEL och använde instrumentet Materials Imaging and Dynamics (MID) vid EuXFEL för att undersöka antikroppsproteinlösningar. Röntgenlasern producerar miljontals blixtar per sekund, vilket gör det möjligt för forskare att undersöka proteiner på tidsskalor som är kortare än en mikrosekund och på längdskalor som är så små som en molekyl.
Att skada proteiner eller få dem att reagera
Vanligtvis kan kombinationen av höga pulsfrekvenser och strålning med hög energi skada proteiner eller få dem att reagera. Men genom att sänka dosen röntgenstrålning och ofta flytta proteinproverna har forskarna hittat ett sätt att undersöka proteinernas dynamik innan skador uppstår, samtidigt som man mäter röntgenstrålens inverkan på proteinernas rörelse.
"MHz-XPCS med låg dosering är en metod som gör det möjligt för oss att undersöka proteindynamiken på ett sätt som tidigare var omöjligt", säger Anders Madsen, medförfattare till studien, ledande forskare vid EuXFEL och ansvarig för MID-instrumentet. "Genom att kombinera den höga pulsfrekvensen hos European XFEL med en minskad stråldos kan vi undersöka nya beteenden hos dessa proteiner".
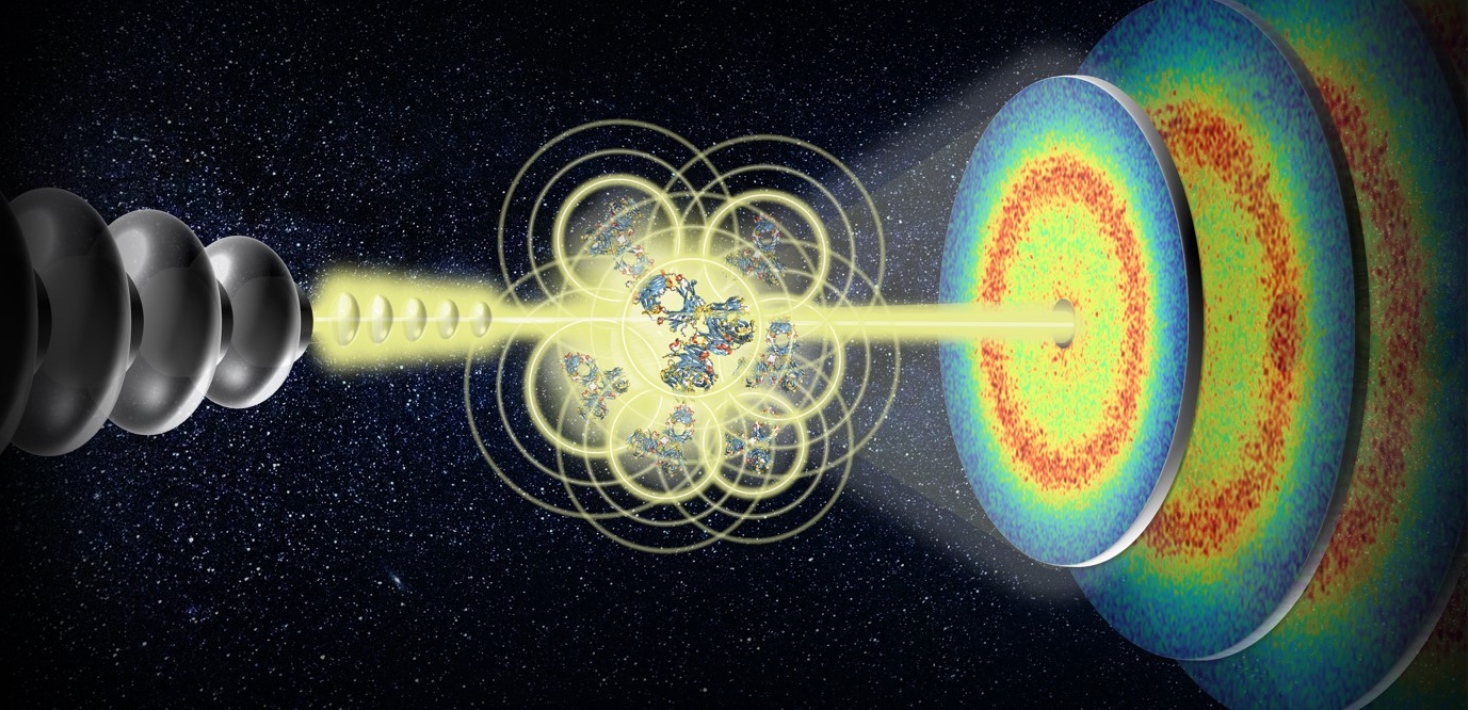
"Proteinernas reaktioner på små skalor, mikrosekund för mikrosekund, är nära kopplade till interaktioner som bestämmer ett antal av deras egenskaper", tillägger Madsen. "Detta kan hjälpa forskarna att utforma nya, modernare läkemedel samt förbättra vår förståelse av proteinrelaterade sjukdomar".
Med hjälp av MHz-XPCS kan forskarna nu också undersöka det kollektiva beteendet hos många proteinmolekyler samtidigt. För att göra detta använde teamet en högkoncentrerad proteinlösning av bovint immunglobulin som efterliknar den trånga och komplexa miljön i en cell.
"Många faktorer påverkar proteinerna i den trånga miljön i våra celler, och alla dessa faktorer bromsar och hindrar proteinernas rörelse", säger professor Foivos Perakis från Stockholms universitet. "Studier visar också att proteiner i trånga cellutrymmen beter sig annorlunda än proteiner i andra system. Alla dessa faktorer måste beaktas för att få en fullständig förståelse för dessa system."
Nya insikter om antikroppsproteiner
Studien har inte bara öppnat en ny väg för undersökningar av proteindynamik - den har också gett nya insikter om antikroppsproteiner i sig, bland annat genom att visa hur spridningen av proteiner i en lösning förändrades med den applicerade stråldosen.
"När läkemedel kommer in i vårt blodomlopp binds de till proteiner som transporterar och distribuerar dem i kroppen", förklarar professor Christian Gutt, motsvarande författare från universitetet i Siegen i Tyskland. "En omfattande förståelse av den här typen av processer skulle kunna leda till effektivare behandlingar med färre biverkningar."
Teamet har nu för avsikt att använda sin nya, lågdoserade MHz-XPCS-teknik för att fylla luckan i vår kunskap om proteiner, där tidigare mättekniker inte kunde användas.
"Röntgenfotonkorrelationsspektroskopi i kombination med den höga repetitionsfrekvensen hos European XFEL kan ge tillgång till dessa relevanta mätparametrar", avslutar Dr Fajun Zhang, forskare vid universitetet i Tübingen i Tyskland. "Viktigt är att den kan ge information om processer som vi har begränsad förståelse för, t.ex. klusterbildning."
Referenser
Upplösning av molekylär diffusion och aggregering av antikroppsproteiner med megahertz-röntgenfrielektronlaserpulser.
M. Reiser*, A. Girelli, A. Ragulskaya, S. Das, S. Berkowicz, M. Bin, M. Ladd-Parada, M. Filianina, H.-F. Poggemann, N. Begam, M. S. Akhundzadeh, S. Timmermann, L. Randolph, Y. Chushkin, T. Seydel, U. Boesenberg, J. Hallmann, J. Möller, A. Rodriguez-Fernandez, R. Rosca, R. Schaffer, M. Scholz, R. Shayduk, A. Zozulya, A. Madsen, F. Schreiber, F. Zhang, F. Perakis* och C. Gutt* [*korresponderande författare] Nature Comm. (2022) DOI:
Mer information
- Foivos Perakis
- Forskningsgrupp SDAQS
- Nat. Commun. 13, 5528 (2022) https://doi.org/10.1038/s41467-022-33154-7
Senast uppdaterad: 10 oktober 2022
Sidansvarig: Fysikum