Inför kemistudier, repetition
Innan du påbörjar dina kemistudier kan det vara bra att repetera gymnasiekunskaperna i både kemi och matte. Första kursen börjar direkt där du slutade på gymnasiet och det är lättare att hänga med om kunskaperna är färska.
Fråga 1:
Hur många gram natrium och hur många gram syre kravs för att främställa 6.2 g Na2O?
Utgå ifrån följande molmassor:
M(Na) = 23 g/mol
M(O)=16/ mol.
Lösning fråga 1
Beräkna molmassan av föreningen Na2O genom att använda molmassorna för elementen samt därefter relationen mellan substansmängd (n), massa (m) och molmassa (M).
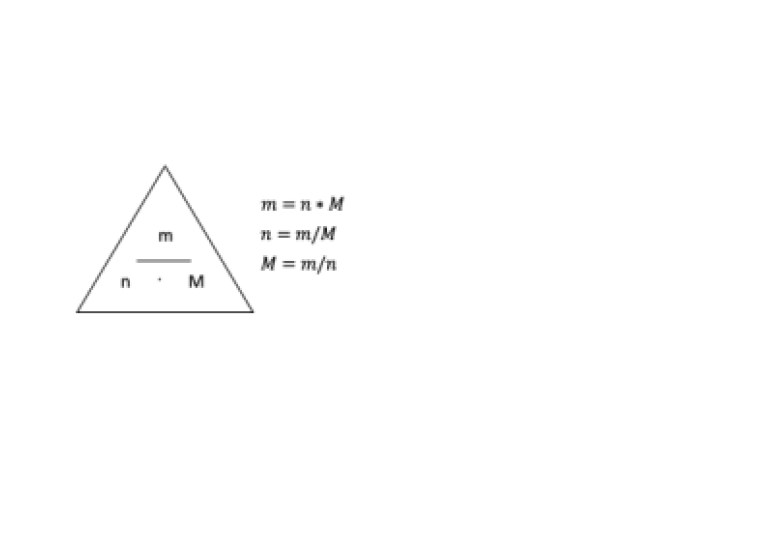
n=0.1000
SVAR: Därmed får vi att det krävs 4.6 gram natrium och 1.6 gram syre för att framställa 6.2 g Na2O.
Psst, du kan lära dig ännu mer om du kollar runt lite på nätet och söker på "stökiometri".
Fråga 2
Beräkna volymen av 1 mol gas vid -73◦ C.
och ett tryck på 100 kPa.Anta att:
R = 8.314 J mol−1 K−1 och att absoluta nollpunkten = -273◦ C.
Lösning fråga 2
Allmänna gaslagen pV = nRT används lämpligen med de olika storheterna uttryckta med SI-enheter. Därmed kan det vara bekvämt att konvertera innan beräkningarna börjar.
T: -73 ◦C = (-73+273)K = 200K.
P: 100kPa = 100000 Pa.
R: 8.314 J mol−1 K−1, d.v.s. gaskonstanten har redan rätt enheter.
n: 1
SVAR: D.v.s. volymen blir 16.6 dm3 eller 16.6 L.
Psst, du kan lära dig ännu mer om du kollar runt lite på nätet och söker på "allmänna gaslagen".
Fråga 3
Förklara vad som menas med entropi. Ge något exempel.
Lösning fråga 3
Entropi kan beskrivas som ett systems frihet att vara oordnat. Ett ordnat system som hålls inom stränga ramar har låg entropi medan ett system som är mera oordnat brukar betecknas med en högre entropi. Entropi anges med symbolen S. Entropi är väldefinierat och har i princip en nollpunkt, vid absoluta nollpunkten har ett rent, helt ordnat system i princip entropin, S = 0. Detta kallas också termodynamikens tredje huvudsats. Generellt kan följande rangordning göras för olika aggregationstillstånd:
S är liten för fasta faser, rätt mycket större för flytande faser men mycket större för gaser.
Psst, du kan lära dig ännu mer om du kollar runt lite på nätet och söker på "entropi".
Fråga 4
Zink löser sig i saltsyra under kraftig värmeutveckling. Ge en balanserad reaktionsformel for denna reaktion. Är reaktionen endoterm eller exoterm? Motivera!
Lösning fråga 4
Zink som löses i saltsyra kan beskrivas med formeln nedan.
På vissa sätt kan saltsyra, HCl (aq) ses som dissocierad i H+(aq) och Cl−(aq) så det finns alternativa sätt att formulera reaktionen på.
Vi ger några förslag nedan. Det faktum att det blir kraftig värmeutveckling kan ses som att värme är en formell produkt. Det faktum att värme avges ar samma sak som att påstå att reaktionen är exoterm.
Zn (s) + 2H+(aq) → Zn2+ (aq) + H2 (g) + värme
Alternativ skrivs hela HCl ut i formeln och därmed blir det kloridjoner över i högerledet.
Zn (s) + 2HCl (aq) → Zn2+ (aq) + H2(g) + 2Cl− (aq) + värme
Det förekommer också att produkten som bildas kallas zinkklorid och anges ZnCl2.
En vattenlösning av zinkklorid, ZnCl2(aq) är samma sak som en lösning av Zn2+ (aq) och 2 Cl−(aq).
Zn (s) + 2HCl (aq) → ZnCl2 (aq) + H2 (g) + värme
Samtliga varianter ar korrekta men den första är kanske lite mer korrekt, eller i allafall lite snyggare...
Psst, du kan lära dig ännu mer om du kollar runt lite på nätet och söker på "termodynamik" och ”reaktionsformler”.
Fråga 5
Vad kännetecknar en svag respektive en stark syra? Beräkna pH-värdet i ättiksyra respektive saltsyra, båda med koncentrationen 0.5 mol/dm3.
Lösning fråga 5
Det som skiljer en svag syra ifrån en stark syra är hur långt driven dissociationen är av syran i lösningsmedlet som ofta är vatten, d.v.s. hur långt förskjuten reaktionen, vid jämvikt, är åt höger. En svag syra är inte särskilt långt förskjuten åt höger, snarare bör den betecknas som förskjuten åt vänster medan en stark syra är långt förskjuten åt höger. En symbolisk syra HA sönderfaller enligt nedan.
För att kvantitativt skilja på svaga och starka syror används jämviktskonstanten för reaktionen ovan, den s.k. syrakonstanten, Ka. Det ar förhållandet mellan högerled och vänsterled. En vanligt förekommande storhet är koncentrationer.
Normalt beräknas [H+(aq)] genom att formulera vad som händer vid jämvikt samt en ekvation for Ka och lösa den enligt nedan.
HA(aq) H+(aq) + A−(aq)
Initialt : Ctot − − Jamvikt :¨ Ctot −x
Jämviktskoncentrationen beskrivs med symbolen ”x”. Uttryck jämviktskonstanten och lös ut x ur ekvationen.
Ka · (Ctot − x) = x2
Symbolen x är alltså ekvivalent med [H+(aq)] varför pH enkelt kan beräknas pH i 0.5 mol/dm3 saltsyra.
Saltsyra är en mycket stark syra, Ka ' 1000. Genom att lösa ekvationen ovan fås följande
pH = 0.30125
Starka syror kan hanteras som att de är fullständigt dissocierade. Detta står skrivet i böcker och det är en hygglig approximation. Det blir samma svar inom tre decimaler.
>> pH = -log10(0.5) pH = 0.30103 pH i 0.5 mol/dm3 Ättika
Ättika eller retansyra som den också kallas är en rätt svag syra,¨Ka ' 2·10−5. Genom att läsa ekvationen ovan på samma sätt som för saltsyra fås följande
>> pH = -log10(ans(2)) pH = 2.5014
Uppenbarligen blir det högre pH i ättikslösningen jämfört med saltsyran, trots att de har samma koncentration. Detta kan också förstås ifrån att ättika anses vara en svag syra, en som inte ger så sura lösningar.
Psst, du kan lära dig ännu mer om du kollar runt lite på nätet och söker på "syror och baser"
Fråga 6
I en lösning är pH = 1. Beräkna vätejonkoncentrationen, [H+(aq)].
Lösning fråga 6
Följande gäller för pH och koncentrationer:
pH = −lg{H+(aq)} ' −lg[H+(aq)] och [H+(aq)] = 10−pH
Koncentrationen av vätejoner vid pH = 1 blir alltså 0.100 mol/dm3.
Psst, du kan lära dig ännu mer om du kollar runt lite på nätet och söker på "pH"
Fråga 7
Balansera reaktionsformeln CuO (s) +NH3 → Cu (s) +N22 (g) +H2O (l). Vilket ämne reduceras och vilket ämne oxideras?
Lösning fråga 7
Reduktion: CuO(s) + 2H+(aq) + 2e− → Cu(s) + H2O(l).
Oxidation: 2NH3 → N2(g) + 6H+(aq) + 6e−.
Summa: 3CuO(s) + 2NH3 → 3Cu(s) + N2(g) + 3H2O(l).
Det är kopparen i kopparoxiden, CuO som reduceras samt kväavet i ammoniaken, NH3 som oxideras.
Psst, du kan lära dig ännu mer om du kollar runt lite på nätet och söker på "redoxreaktioner”.
Fråga 8
Förklara kort vad som karaktäriserar följande bindningar. Rangordna även bindningarna utifrån hur starka de är.
a.) Jonbindning.
b.) Vätebindning.
c.) Kovalent bindning.
d.) van der Waals bindning.
Lösning fråga 8
Följande bindningar kan karaktäriseras och rangordnas enligt bindningsstyrka som följer.
- Jonbindning och kovalent bindning är båda exempel på starka bindningar. Bindningsstyrkan är flera hundra kJ/mol.
- Vätebindningar är exempel på ovanligt starka dipol-dipolbindnigar, exempelvis mellan vattenmolekyler vars bindningsstyrka kan vara 10-30 kJ/mol.
- van der Waals bindning är svaga bindningar exempelvis mellan organiska molekyler. Bindningstyrkan är ofta bara några få kJ/mol.
Psst, du kan lära dig ännu mer om du kollar runt lite på nätet och söker på "kemiska bindningar”.
Fråga 9
Vad innebär det att en kemisk reaktion nått jämvikt?
Lösning fråga 9
Om en kemisk reaktion nått jämvikt betyder det att ingen nettoförändring sker. Det betyder inte att systemet har antagit ett statiskt tillstånd utan fortfarande sker både framåtreaktion respektive bakåtreaktion men ingen nettoförändring sker.
Ibland används begreppet ”dynamisk jämvikt för att framhäva detta.
Psst, du kan lära dig ännu mer om du kollar runt lite på nätet och söker på "kemisk jämvikt”.
Fråga 10
En reaktion har jämviktskonstanten, K = 0.01
Vilken koncentration är högst efter det att jämvikt ställt in sig? Är det koncentrationen av reaktanter eller produkter?
Motivera svaret!
Lösning fråga 10
Om jämviktskonstanten för en reaktion är liten, d.v.s. mycket mindre än 1, i det här fallet var K = 0,01. Detta betyder att reaktanterna dominerar blandningen. Detta kan inses ifrån definitionen på jämviktskonstant, vilken är förhållandet mellan produkten och reaktanter. Alltså produkten dividerat med alla reaktanter.
Har K värdet 0.01 kan detta tolkas som att nämnaren är 100 gånger så stor som täljaren.
Psst, du kan lära dig ännu mer om du kollar runt lite på nätet och söker på "kemisk jämvikt”
Fråga 11
Utveckla följande uttryck:
a.) (3x − 2)(3x − 2)
b.) 3(3x − 2(3x + 2)
c.) (x − 3)(x + 2)(x − 1)
Lösning fråga 11
a. (3x − 2)(3x − 2) = 9x2 − 12x + 4
b. 3(3x − 2(3x + 2)) = 27x2 − 12
c. (x − 3)(x + 2)(x − 1) = x3 − 2x2 − 5x + 6
Psst, du kan lära dig ännu mer om du kollar runt lite på nätet och söker på "multiplikation av parenteser”.
Fråga 12
Ange värdet för:
• lg(1)
• ln(1)
• lg(10)
• ln(10)
Lösning fråga 12
Octavekoden for beräkningar ges här nedan. Med Octave anges lg med funktionen log10 och ln med funktionen log.
log10(1) ans =0
log(1) ans = 0
log10(10) ans = 1
log(10) ans = 2.3026
Psst, du kan lära dig ännu mer om du kollar runt lite på nätet och söker på ”logaritmer” alternativt ”exponentialfunktioner”. Dessa begrepp är viktiga att förstå och kunna då många skalor och begrepp skrivs som logaritmer. Till exempel pH eller populationstillväxt.
Fråga 13
Rita graferna till följande funktioner:
a.) y = x2
b.) y = √x
c.) y = √x2
d.) y = ex
e.) y = ln(x)
f.) y = ln(ex)
Lösning fråga 13
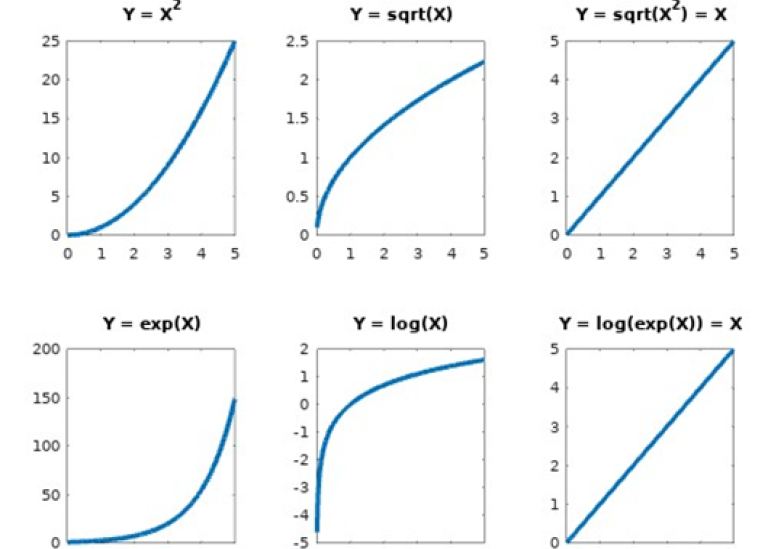
Psst, du kan lära dig ännu mer om du kollar runt lite på nätet och söker på ”koordinatsystem” och ”grafer”. Du kommer behöva göra många grafiska lösningar av mätvärden inom kemin och en linjes ekvation kan användas för att beräkna värden som inte är direkt mätbara.
Fråga 14
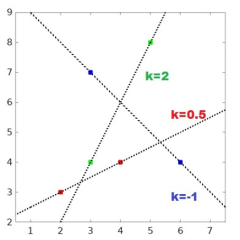
Beräkna lutningen av linjerna som går igenom paren av punkter nedan. Rita gärna en liten skiss.
• (2,3) och (4,4)
• (3,4) och (5,8)
• (6,4) och (3,7)
Lösning fråga 14
De olika punktparen har markerats i figuren nedan med olika färger. Linjerna som går igenom punkterna har markerats med streckade linjer. Lutningen av en linje som går igenom två punkter kan alltid beraknas med formeln nedan. Det spelar ingen roll vilken punkt som anges med (x1,y1) respektive (x2,y2).
Linjens ekvation
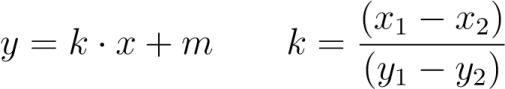
Psst, du kan lära dig ännu mer om du kollar runt lite på nätet och söker på ”räta linjens ekvation”. Du kommer behöva göra många grafiska lösningar av mätvärden inom kemin och en linjes ekvation kan användas för att beräkna värden som inte är direkt mätbara.
Fråga 15
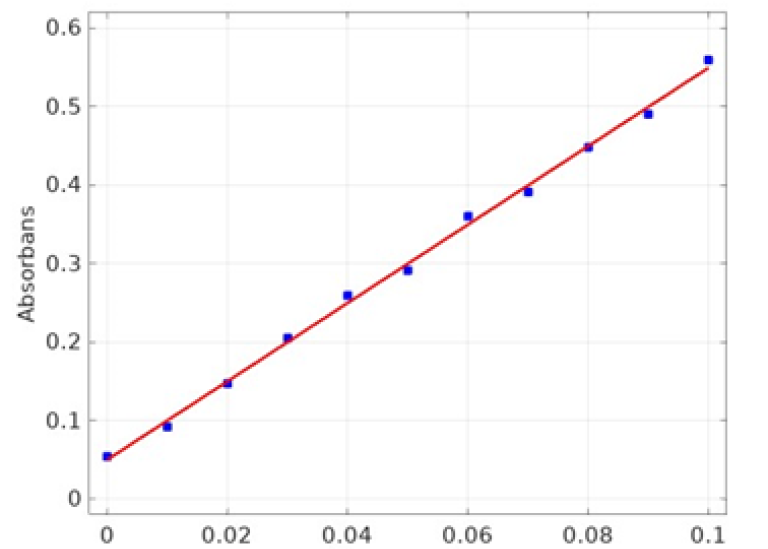
En kalibreringskurva for spektrofotometrisk analys av [Cu2+] konstrueras genom att mäta absorbansen för några olika standardprover. Absorbansen vid några olika koncentrationer ges nedan. Det finns lite mätfel i absorbansvärdena, vilket betyder att kurvan inte blir spikrak, men en anpassad regressionslinje kan skapas på många olika sätt.
|
Koncentration |
Absorbans |
|
0.000 |
0.054 |
|
0.010 |
0.092 |
|
0.020 |
0.147 |
|
0.030 |
0.205 |
|
0.040 |
0.259 |
|
0.050 |
0.291 |
|
0.060 |
0.360 |
|
0.070 |
0.391 |
|
0.080 |
0.448 |
|
0.090 |
0.490 |
| 0.100 |
0.559 |
- Anpassa en regressionslinje med kalkylator eller något lämpligt program och bestäm på så sätt en ekvation för kalibreringskurvan.
- Bestäm slutligen koncentrationen i ett okänt prov som har absorbansen 0.386 när det mäts under samma förhållanden som standardkurvan.
Lösning fråga 15
Standardkurva.
Mätpunkter och en anpassad rät linje.
Beräknas konstanterna i linjens ekvation.
Detta ger
Abs = 4.993636 · konc + 0.049955
Detta leder till att variabeln konc kan utryckas som:
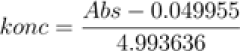
konc = 0.067295
Notera att i det här exemplet angavs ingen enhet för koncentrationen. På riktigt så skulle en koncentration aldrig anges utan en enhet så kom därför ihåg att alltid ange en enhet när du håller på med koncentrationer. Du kommer behöva göra många grafiska lösningar av mätvärden inom kemin och en linjes ekvation kan användas för att beräkna värden som inte är direkt mätbara.
Om du vill lära dig ännu mer om regressionslinjer så sök runt lite på internet.
Senast uppdaterad: 12 april 2022
Sidansvarig: Kemiska sektionens kansli & studentexpedition

