Forskningsprojekt Personlig behandlingsplanering för stereotaktisk strålbehandling av höggradig gliom
Stereotaktisk strålbehandling är en mycket framgångsrik strålbehandlingsmetod för vissa typer av cancer som innebär att behandlingen ges i en (radiokirurgi) eller ett fåtal sessioner.
Stereotaktisk strålbehandling är en mycket framgångsrik strålbehandlingsmetod för vissa typer av cancer som innebär att behandlingen ges i en (radiokirurgi) eller ett fåtal sessioner. Den bygger på en noggrann definition av de volymer som begränsar de maligna cellerna och de organ som riskerar att bestrålas, eftersom en mycket hög stråldos planeras att levereras till målet för att säkerställa att de maligna klonogena cellerna steriliseras. Det finns dock flera fall där behandlingen inte lyckas eller nekas patienterna på grund av osäkerheten om målets position och omfattning. En av de mest problematiska hjärntumörerna i detta avseende är gliom, särskilt höggradig gliom. Glioblastom är till exempel mycket välkänt för att infiltrera hjärnvävnaden långt från den synliga tumörmassan på diagnostiska bilder. En ny filosofi för att definiera målet för gliom och en motsvarande ny strategi för klinisk behandling av gliom håller nu på att växa fram i form av personlig probabilistisk måldefinition och behandlingsplanering som syftar till att säkerställa en robust dostillförsel med hänsyn till måldefinitionen och därmed till att patienten botas.
Det är därför det övergripande målet med detta projekt att utveckla ramarna för personlig behandlingsplanering för stereotaktisk strålbehandling som tar hänsyn till osäkerheter i måldefinitionen och målpositionen för höggradigt gliom.
Projektets specifika mål är följande:
1. Att utveckla metoderna och beräkningsverktygen för personlig probabilistisk planering som tar hänsyn till osäkerheter i måldefinition, omfattning och position för höggradig gliom.
2. Att validera modellen för probabilistisk måldefinition på en kohort av gliobastompatienter och jämföra resultaten med den nuvarande state-of-the-art definitionen av målet.
3. Att testa modellen för måldefinition på en delmängd fall av glioblastom.
Projektet förväntas, baserat på bättre måldefinition och individualiserade probabilistiska och robusta behandlingsplaner, bidra till att öka strålbehandlingens framgång och därmed öka den totala överlevnaden för glioblastompatienter, som för närvarande i genomsnitt är mindre än 15 månader.
Projektbeskrivning
Att leverera en mycket konform dosfördelning till målet i en fraktion och samtidigt skona normal vävnad och kritiska strukturer är en del av grundkonceptet för stereotaktisk radiokirurgi (SRS). Förutsatt att man använder den mycket noggranna radiokirurgiska utrustning som finns tillgänglig idag, t.ex. Gamma Knife eller avancerad linacbaserad teknik, är det möjligt att planera och leverera den föreskrivna dosfördelningen, och därför är den viktigaste frågan som återstår att lösa att definiera målet. Eftersom planeringsmålvolymen inom radiokirurgi historiskt sett definierades utan marginaler, på grund av den exakta stereotaktiska definitionen av koordinatsystemet och den rigida immobiliseringen av patienten, är framgången för det stereotaktiska tillvägagångssättet kritiskt beroende av en noggrann avgränsning av målet. Detta skulle kunna identifieras som en faktor av central betydelse inom radiokirurgi. Den nuvarande synen på målvolymen inom SRS är binär i den meningen att man utgår från att målcellerna med säkerhet är begränsade inom den avgränsade gränsen och att optimeringen av behandlingsplaneringen därför syftar till att uppnå en hög täckning av målvolymen med en föreskriven dos och hög selektivitet, vilket innebär en brant nedgång i dosfördelningen utanför målvolymen. Detta tycks dock försumma den mikroskopiska tumörspridningen och återspeglar inte osäkerheten i tumörens omfattning, form och läge.
Vår grupp har därför utfört ett omfattande arbete för att bedöma variabiliteten i målens konturering och därmed definitionen av målen vid strålkirurgi. Mer specifikt analyserades och kvantifierades multiobservatörsvariabiliteten i avgränsningen av strålkirurgiska mål. Den potentiella effekten av skillnaderna i målavgränsning med avseende på sannolikheten för tumörkontroll undersöktes också och en robust metod för att uppskatta det verkliga målet för enskilda fall baserat på flera avgränsningar utvecklades. Möjligheten att ta hänsyn till fel i målavgränsningen genom probabilistisk och robust behandlingsplanering har därför börjat undersökas.
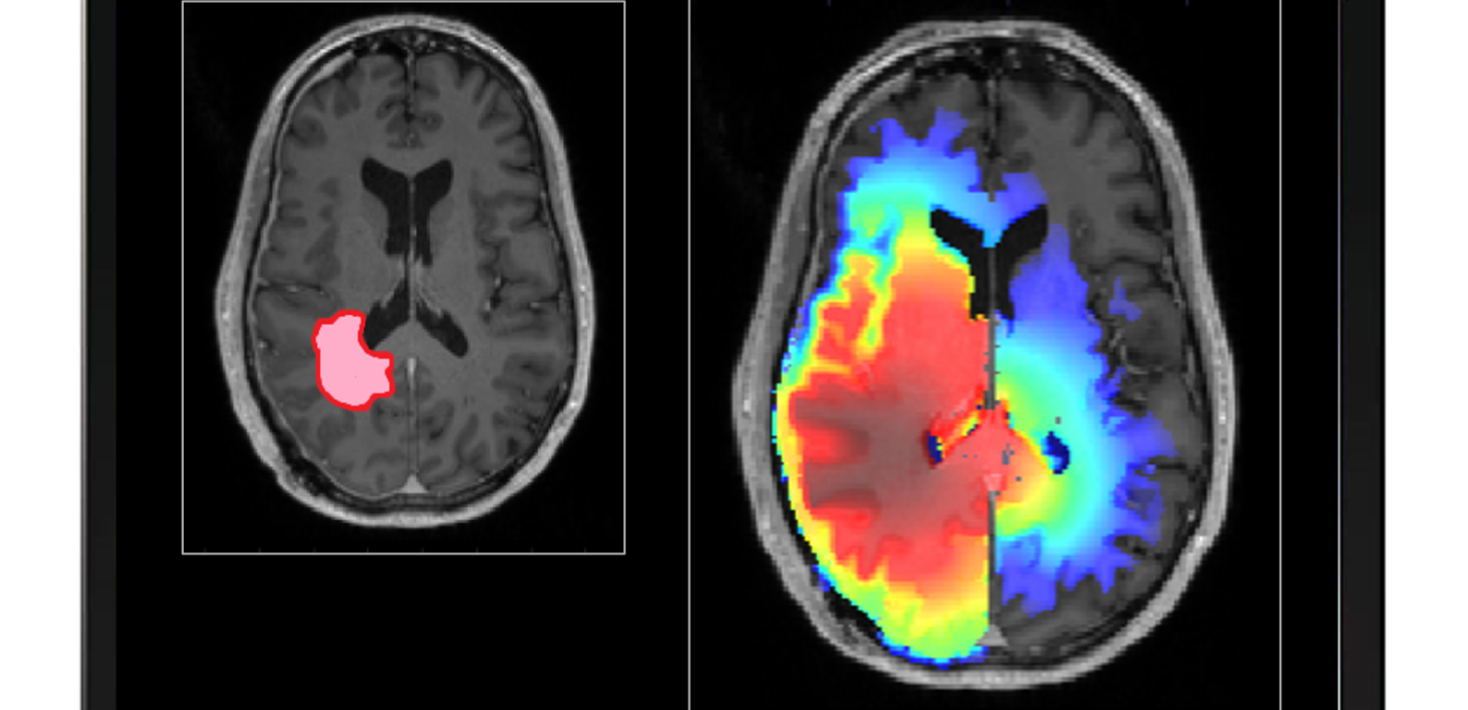
Det tidigare arbetet med att bedöma variabiliteten i måldefinitionen visade att vissa strålkirurgiska mål, t.ex. höggradiga gliom, är mer benägna än andra att uppvisa stor variabilitet i avgränsningen av den volym som ska bestrålas. Glioblastom, tumörer med en väldokumenterad infiltrativ karaktär i normala vävnader, är därför ett typiskt exempel på dessa mål som är benägna till variabilitet. Att definiera målet för glioblastom är inte en trivial uppgift utan ett individuellt kritiskt kliniskt problem eftersom tumörcellerna infiltrerar hjärnvävnaden bortom den abnormitet som syns på magnetresonanstomografi (MRI). Isolerade tumörceller kan hittas genom biopsiprover utanför den hyperintensiva volymen på T2-viktade MR-undersökningar och följaktligen ligger 80 % av återfallen inom en 2 cm marginal från den kontrastförstärkta lesionen. I EORTC-riktlinjerna (European Organisation for Research and Treatment of Cancer) för avgränsning av höggradiga gliom rekommenderas därför för ett enda mål en dos som biologiskt motsvarar 60 Gy i 2 Gy per fraktion och som ska levereras till en klinisk målvolym som definieras som en isotropisk utvidgning på 2 cm av den volym som avgränsats på grundval av en kontrastförstärkande T1-viktad MRT-skanning. En marginal på 2 cm rekommenderas också av Radiation Therapy Oncology Group (RTOG) i USA. Denna stora marginal begränsar valmöjligheterna när det gäller vilka strålbehandlingsmetoder som skall användas vid behandling av glioblastom till förmån för linac-baserad fraktionerad strålbehandling med måttlig framgång. Faktum är att det genomsnittliga antalet astrocytom/glioblastomfall som behandlats med den radiokirurgiskt inriktade Gamma Knife-tekniken vid Karolinska universitetssjukhuset, till exempel, har minskat från 5,0±1,7 % av det totala antalet diagnoser mellan 2008 och 2018 till endast 1,8 % år 2019, och en av de viktigaste orsakerna till denna minskning är osäkerheten i definitionen av målomfånget på grund av infiltrationen i den normala vävnaden. Den nuvarande kliniska erfarenheten tyder verkligen på att förbättringar av strålbehandling inte ensamma kommer att leda till att patienterna botas. När det gäller effektivitet är strålbehandling mot glioblastom dock den ledande terapiformen som bidrar till att förlänga patienternas överlevnad. Förbättrad måldefinition kan därför ha potential att öka strålbehandlingens förmåga att hantera gliom och eventuellt öka patienternas överlevnad och minska den behandlingsrelaterade toxiciteten.
För att förstå den mikroskopiska tumörutvecklingen krävs i allmänhet en tvärvetenskaplig insats som omfattar strålningsonkologer, radiologer, patologer och kirurger, men medicinska fysiker och datavetare har en roll att spela när det gäller att definiera det kliniska målet bortom avbildningen med hjälp av beräkningsmetoder. Detta faktum har uppmärksammats inom European SocieTy for Radiotherapy and Oncology (ESTRO) och en arbetsgrupp har inrättats.
Arbetsgruppens uppgift är att ersätta den besvärliga manuella processen för att definiera den kliniska målvolymen (CTV) med en till stor del datoriserad process som gör det möjligt för användaren att göra justeringar och definiera steg/data/frågor för att skapa en personlig metod för att definiera CTV. Kärngruppen av ledande forskare i detta initiativ består av professor Jan Unkelbach (gruppledare för medicinsk fysikforskning, universitetet i Zürich, Schweiz), professor Vincent Grégoire (chef för avdelningen för strålningsonkologi vid Léon Bérard Cancer Center, Lyon, Frankrike), dr Cristina Garibaldi (avdelningen för medicinsk fysik, European Institute of Oncology, Milan, Italien), Dr Nick Reynaert (avdelningen för medicinsk fysik, Institut Jules Bordet, Bryssel, Belgien), professor Thomas Bortfeld (chef för fysikavdelningen, Massachusetts General Hospital, Boston MA, USA), professor Marcel van Herk (professur i fysik för strålterapi, University of Manchester, Storbritannien) och professor Iuliana Toma-Dasu (avdelningen för fysik, Stockholms universitet).
Betydande kliniska ansträngningar har gjorts för att avbilda glioblastom i ett försök att bättre definiera strålbehandlingsmålet. Funktionella avbildningsmetoder som t.ex. positronemissionstomografi (PET) med användning av fluoroetyltirosin (FET) och metionin (MET) i kombination med MRT är lovande för att förbättra definitionen av GTV. De kan dock inte kartlägga områden med infiltration av tumörceller långt från den synliga tumörgränsen som syns på MRT. Följaktligen har flera matematiska modeller som syftar till att reproducera gliomets komplexa rumsliga tillväxtmönster utvecklats, men deras kliniska effekt har hittills varit mycket begränsad. I linje med detta har en modell för höggradiga gliom med en utbredd infiltration bortom den lesion som kan upptäckas på diagnostiska bilder utvecklats inom vår grupp. Behandlingsplaner för Gamma Knife radiokirurgi (GKRS) med olika kombinationer av dosförskrivning och målutbredning utformades och utvärderades med hjälp av standardiserade konformitetsindex (CI) och radiobiologiska parametrar. Betydande skillnader i fråga om sannolikheten för tumörkontroll konstaterades mellan planer med liknande CI men med olika mål. Slutsatsen är att det är av central betydelse att ta hänsyn till infiltration av tumörceller utanför målet vid GKRS och att en radiobiologisk utvärdering bör åtfölja väletablerade CI.
Beroende på målets storlek är strålkirurgi i en enda fraktion kanske inte alltid den bästa behandlingen, trots dess obestridliga radiobiologiska fördelar, på grund av de begränsningar som riskorganen medför. Utvecklingen av den nya generationen av GK-apparaten med ett ramlöst immobiliseringssystem har inte bara ökat patientens komfort genom att ta bort den stereotaktiska ramen utan har också öppnat möjligheten att utföra fraktionerade behandlingar och därmed utökat behandlingsmetoderna för fraktionerad strålbehandling av gliompatienter. Denna nya möjlighet medför dock, förutom de obestridliga fördelarna, en anledning till oro när det gäller den potentiella patientrörelsen inom maskramen, som vid linacbaserad strålkirurgi, och därmed målförskjutning i förhållande till planeringsläget. Begränsad information finns tillgänglig om omfattningen av förflyttning och därför inleddes nyligen en studie av huvudsökanden och hennes medarbetare tillsammans med GK-enheten vid strålningsonkologiavdelningen, Princess Alexandra Hospital, Brisbane, Australien, i syfte att hitta osäkerheterna i mållokaliseringen.
Dessa fel och osäkerheter i definitionen och placeringen av målet kan påverka behandlingsresultatet negativt och måste därför behandlas oavsett om behandlingen ska utföras med GK- eller linacbaserad utrustning. Syftet med detta forskningsförslag är att dra nytta av kunskapen om dessa osäkerheter genom att använda dem som indata för personlig probabilistisk planering som syftar till att leverera robusta dosfördelningar.
Det övergripande målet med detta projekt är därför att öka sannolikheten för att kontrollera tumören för höggradiga gliom genom att genom probabilistisk planering ta hänsyn till flera nyckelfaktorer inom stereotaktisk strålbehandling: osäkerheterna i målets utbredning för tumörer av infiltrativ karaktär och osäkerheterna i målets position under behandlingen.
Idén att skapa en in silico testbädd för strålbehandling baserad på en virtuell tumörmodell som tar hänsyn till de viktigaste egenskaperna i tumörens mikromiljö som man vet har samband med resultatet av strålbehandling integrerat i ett system för planering och optimering av behandling har en mycket hög nyhetsfaktor, eftersom den, såvitt sökanden känner till, aldrig har presenterats tidigare. In silico-utredningen är oerhört viktig eftersom den skulle kunna bidra till att utforma kliniska prövningar som syftar till att optimera patienturvalet för olika former av strålbehandling och därmed maximera patienternas nytta genom in silico-utredningen.
Fördelarna för patienterna genom att i silico bedöma den relativa kliniska effektiviteten av proton- eller jonstrålbehandling jämfört med den vanliga metoden med fotonerapi.
Den teoretiska modelleringen av en tumör in silico har också potential att snabbt identifiera den relativa betydelsen av de faktorer som bestämmer svaret på behandlingen och därmed hjälpa till att utforma de kliniska prövningarna, före eller till och med utan långvariga och kostsamma experimentella studier i djurmodeller. För närvarande utförs många prekliniska studier på djur där tumörer framkallas och tillåts utvecklas. Det uppstår därför en etisk fråga om användningen av djur i forskning om (kemo-)strålbehandling, och därför bör man alltid söka alternativa lösningar till djurförsök. Denna ersättningsprincip för modern forskning har specificerats tillsammans med minskning och förfining i direktiv 2010/63/EU om skydd av djur som används för vetenskapliga ändamål. I den virtuella verklighetens era har tumörmodeller som skapats in silico potential att möjliggöra framsteg inom forskningen och samtidigt minimera användningen av djur för försök, vilket uppfyller rekommendationerna i direktiv 2010/63/EU.
Projektmedlemmar
Projektansvariga
Iuliana Livia Dasu
Professor

Medlemmar
Marta Lazzeroni
Universitetslektor